 |
91樓 久晴初雨
2013-4-14 17:04

配位鍵是一種特殊的共價鍵,它的特點在於共用的一對電子出自同一原子。形成配位鍵的條件是,一個原子有孤電子對,而另一個原子有空軌道。配位化合物,尤其是過渡金屬配合物,種類繁多,用途廣泛,現已形成配位化學。
|
 |
92樓 浅风仁樱
2013-4-14 17:16

1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p
|
 |
93樓 浅风仁樱
2013-4-14 17:18

泡利不相容原理。指的是在每個原子軌道里,最多只能容納2個電子,而且它們的自旋相反(用「↑」和「↓」表示)。由此可知,s軌道都只能容納兩個電子(磁量子數為1),而p軌道都能容納6個電子(磁量子數為3,有3個等價軌道:2px,2py,2pz)
|
 |
94樓 浅风仁樱
2013-4-14 17:19

洪特規則。也就是說在能量相等的軌道上,電子儘可能自旋平行地多佔不同的軌道。怎樣的軌道能量才相等呢?主量子數和角量子數相同的軌道能量相等。例如2p軌道,其中2px、2py、2pz三個軌道的能量相等,叫做等價軌道。
|
 |
95樓 浅风仁樱
2013-4-14 18:00

|
 |
96樓 浅风仁樱
2013-4-14 18:02

傳說中的薛方   |
 |
97樓 浅风仁樱
2013-4-14 18:33

s軌道是呈球對稱的 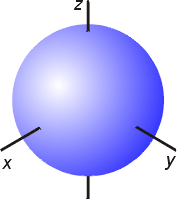
|
 |
98樓 浅风仁樱
2013-4-14 19:30

|
 |
99樓 浅风仁樱
2013-4-16 18:43

|
 |
100樓 浅风仁樱
2013-4-18 20:46

書寫軌道表示式除須遵守上述三個原則之外,還要參考核外電子的排布方法。在此僅作簡單的介紹:
對於某元素原子的核外電子排布情況,先確定該原子的核外電子數(即原子序數、質子數、核電荷數),如24號元素鉻,其原子核外總共有24個電子,然後將這24個電子從能量最低的1s亞層依次往能量較高的亞層上排布,只有前面的亞層填滿後,才去填充後面的亞層,每一個亞層上最多能夠排布的電子數為:s亞層2個,p亞層6個,d亞層10個,f亞層14個。最外層電子到底怎樣排布,還要參考洪特規則,如24號元素鉻的24個核外電子依次排列為
1s22s22p63s23p64s23d4
根據洪特規則,d亞層處於半充滿時較為穩定,故其排布式應為:
1s22s22p63s23p64s13d5
最後,按照人們的習慣「每一個電子層不分隔開來」,改寫成
1s22s22p63s23p63d54s1
|