|
◇◆◇◆◇◆化学召唤师吧水库◆◇◆◇◆◇ |
 法師學徒 三級 |
配位键是一种特殊的共价键,它的特点在于共用的一对电子出自同一原子。形成配位键的条件是,一个原子有孤电子对,而另一个原子有空轨道。配位化合物,尤其是过渡金属配合物,种类繁多,用途广泛,现已形成配位化学。
|
 召喚法師 十級 |
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p
|
 召喚法師 十級 |
泡利不相容原理。指的是在每个原子轨道里,最多只能容纳2个电子,而且它们的自旋相反(用“↑”和“↓”表示)。由此可知,s轨道都只能容纳两个电子(磁量子数为1),而p轨道都能容纳6个电子(磁量子数为3,有3个等价轨道:2px,2py,2pz)
|
 召喚法師 十級 |
洪特规则。也就是说在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。怎样的轨道能量才相等呢?主量子数和角量子数相同的轨道能量相等。例如2p轨道,其中2px、2py、2pz三个轨道的能量相等,叫做等价轨道。
|
 召喚法師 十級 |
|
 召喚法師 十級 |
传说中的薛方   |
 召喚法師 十級 |
s轨道是呈球对称的 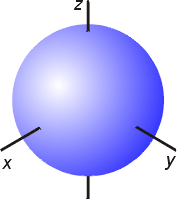
|
 召喚法師 十級 |
|
 召喚法師 十級 |
|
 召喚法師 十級 |
书写轨道表示式除须遵守上述三个原则之外,还要参考核外电子的排布方法。在此仅作简单的介绍:
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
|
 召喚法師 十級 |
|